(4分)根据不同种金属与同种酸能否反应以及反应的剧烈程度,可判断金属的活动性。也可根据同种金属与不同种酸反应的快慢,来判断不同种酸的酸性强弱。为比较盐酸和醋酸的酸性强弱,设计了如下实验方案。装置如右图
发布时间:2019-08-08 04:27:24
试题难度:难度:偏难 试题类型:实验题 试题内容:(4分)根据不同种金属与同种酸能否反应以及反应的剧烈程度,可判断金属的活动性。也可根据同种金属与不同种酸反应的快慢,来判断不同种酸的酸性强弱。
为比较盐酸和醋酸的酸性强弱,设计了如下实验方案。装置如右图所示(夹持和固定装置已略去)。
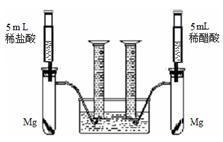
在两试管中分别加入过量镁条,同时将相同浓度的稀盐酸和稀醋酸注入相应试管中,观察产生氢气的速率和体积。
试回答下列问题:
(1)盐酸与镁反应的化学方程式为 ,反应的基本类型为 。
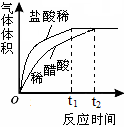
(2)实验中收集到氢气的体积与时间的关系如图所示。分析图中曲线变化规律,可得出盐酸酸性比醋酸(填“强”或“弱”) 。
(3)实验中稀盐酸与镁条反应时,量筒中收集到氢气的体积比理论值高,可能的原因是 。
①反应放热 ②试管中有氢气残留
③实验装置气密性不好 ④酸液进入试管,占据了一定的体积
为比较盐酸和醋酸的酸性强弱,设计了如下实验方案。装置如右图所示(夹持和固定装置已略去)。

在两试管中分别加入过量镁条,同时将相同浓度的稀盐酸和稀醋酸注入相应试管中,观察产生氢气的速率和体积。
试回答下列问题:
(1)盐酸与镁反应的化学方程式为 ,反应的基本类型为 。
(2)实验中收集到氢气的体积与时间的关系如图所示。分析图中曲线变化规律,可得出盐酸酸性比醋酸(填“强”或“弱”) 。

(3)实验中稀盐酸与镁条反应时,量筒中收集到氢气的体积比理论值高,可能的原因是 。
①反应放热 ②试管中有氢气残留
③实验装置气密性不好 ④酸液进入试管,占据了一定的体积
推荐回答
试题答案:(1) Mg +2HCl = MgCl2+H2↑ 置换(2) 强(3) ①④以上问题属网友观点,不代表本站立场,仅供参考!