镁是“国防金属”,从海水中提取镁通常要经历三大步骤见下图:请回答下列问题:(1)步骤1是提高海水中Mg2+浓度,方法是 。(2)步骤2的离子方程式为
发布时间:2019-08-08 04:26:58
试题难度:难度:中档 试题类型:填空题 试题内容:镁是“国防金属”,从海水中提取镁通常要经历三大步骤见下图:

请回答下列问题:
(1)步骤1是提高海水中Mg2+浓度,方法是 。
(2)步骤2的离子方程式为 。
已知Mg(OH)2的Ksp=5.61×10-12,假设浓缩海水中MgCI2浓度为3mo1/L,则要使Mg2+形成Mg( OH )2沉淀,则加入沉淀剂后海水中的OH-浓度至少要达到 。
工业生产为了获得更高的利润,根据表1分析,最合理的沉淀剂是_ ,生产这种沉淀剂的方法是 。
表1试剂价格
试剂
KOH
NaOH
Ca(OH)2
价格(元/吨)
6800
3200
1200
(3)步骤3如何实现?两位同学设计下列方案:
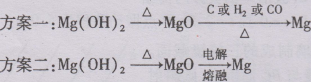
这两种方案是否合理?请你评价:
方案一: 。
方案二: 。
你的设计方案是什么?写出流程图:
。

请回答下列问题:
(1)步骤1是提高海水中Mg2+浓度,方法是 。
(2)步骤2的离子方程式为 。
已知Mg(OH)2的Ksp=5.61×10-12,假设浓缩海水中MgCI2浓度为3mo1/L,则要使Mg2+形成Mg( OH )2沉淀,则加入沉淀剂后海水中的OH-浓度至少要达到 。
工业生产为了获得更高的利润,根据表1分析,最合理的沉淀剂是_ ,生产这种沉淀剂的方法是 。
表1试剂价格
试剂
KOH
NaOH
Ca(OH)2
价格(元/吨)
6800
3200
1200
(3)步骤3如何实现?两位同学设计下列方案:
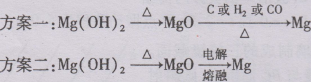
这两种方案是否合理?请你评价:
方案一: 。
方案二: 。
你的设计方案是什么?写出流程图:
。
推荐回答
试题答案:(15分)(1)取海水晒盐后的苦卤水作原料(其它合理答案给分,2分)(2)Mg2++2OH-=Mg(OH)2↓或Mg2++Ca(OH)2=Mg(OH)2↓+Ca2+(2分);×10-6mol/L(2分,回答1.36×10-6mol/L也可);Ca(OH)2(1分);以海边的贝壳高温分解制生石灰,生石灰与水反应制得石灰乳(2分)(3)方案一:不合理,H2、C或CO均不能还原MgO(2分)方案二:不合理,MgO熔点高,能耗大,不经济(2分)合理方案:(2分)以上问题属网友观点,不代表本站立场,仅供参考!
- 上一条:重金属污染物对人体的危害巨大
- 下一条:重金属离子对河流及海洋造成严