在硫酸工业生产过程中,有反应2SO2(g)+O2(g)2SO3(g)(正反应为放热反应),根据下表提供的不同压强下SO2的转化率(%)的数据试选择该反应的适宜条件(以V2O5作催化剂)(1)温度___
发布时间:2019-08-07 04:45:37
试题难度:难度:中档 试题类型:填空题 试题内容:在硫酸工业生产过程中,有反应2SO2(g)+O2(g)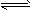 2SO3(g)(正反应为放热反应),根据下表提供的不同压强下SO2的转化率(%)的数据试选择该反应的适宜条件(以V2O5作催化剂)
2SO3(g)(正反应为放热反应),根据下表提供的不同压强下SO2的转化率(%)的数据试选择该反应的适宜条件(以V2O5作催化剂)
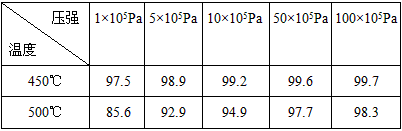 (1)温度____________;(2)压强____________。
(1)温度____________;(2)压强____________。
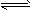 2SO3(g)(正反应为放热反应),根据下表提供的不同压强下SO2的转化率(%)的数据试选择该反应的适宜条件(以V2O5作催化剂)
2SO3(g)(正反应为放热反应),根据下表提供的不同压强下SO2的转化率(%)的数据试选择该反应的适宜条件(以V2O5作催化剂)  (1)温度____________;(2)压强____________。
(1)温度____________;(2)压强____________。 推荐回答
还没有选出推荐答案,请稍候访问或查看其他回答!以上问题属网友观点,不代表本站立场,仅供参考!