(本题16分)钼酸钠晶体(Na2MoO4·2H2O)是无公害型冷却水系统的金属缓蚀剂,由钼精矿(主要成分是MoS2,含少量PbS等)制备钼酸钠晶体的部分流程如下:(1)焙烧的过程中采用的是“逆流焙烧”
发布时间:2019-08-07 05:00:58
试题难度:难度:中档 试题类型:填空题 试题内容:(本题16分)钼酸钠晶体(Na2MoO4·2H2O)是无公害型冷却水系统的金属缓蚀剂,由钼精矿(主要成分是MoS2,含少量PbS等)制备钼酸钠晶体的部分流程如下:
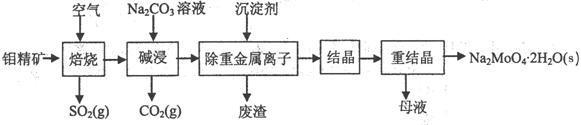 (1)焙烧的过程中采用的是“逆流焙烧”的措施,则该措施的优点是:①_______________
(1)焙烧的过程中采用的是“逆流焙烧”的措施,则该措施的优点是:①_______________
②____________________________
(2)写出焙烧时生成MoO3的化学方程式为:______________________________________
(3)写出“碱浸”反应的离子方程式:
(4)重结晶得到的母液可以在下次重结晶时重复使用,但达到一定次数后必须净化处理,原因是 。
(5)下图是碳钢在3种不同介质中的腐蚀速率实验结果:
①碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异,其原因可能是 ________________。
②空气中钼酸盐对碳钢的缓蚀原理是在钢铁表面形成FeMoO4—Fe2O3保护膜。
密闭式循环冷却水系统中的碳钢管道缓蚀,除需加入钼酸盐外还需加入NaNO2。则NaNO2的作用是 _________________________________________。
③若缓释剂钼酸钠—月桂酸肌氨酸总浓度为300mg·L-1,则缓蚀效果最好时钼酸钠的物质的量浓度为
(6)锂和二硫化钼形成的二次电池的总反应为:xLi + nMoS2 Lix(MoS2)n。则电池放电时的正极反应式是:___________________________________。
Lix(MoS2)n。则电池放电时的正极反应式是:___________________________________。
 (1)焙烧的过程中采用的是“逆流焙烧”的措施,则该措施的优点是:①_______________
(1)焙烧的过程中采用的是“逆流焙烧”的措施,则该措施的优点是:①_______________②____________________________
(2)写出焙烧时生成MoO3的化学方程式为:______________________________________
(3)写出“碱浸”反应的离子方程式:
(4)重结晶得到的母液可以在下次重结晶时重复使用,但达到一定次数后必须净化处理,原因是 。
(5)下图是碳钢在3种不同介质中的腐蚀速率实验结果:

①碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异,其原因可能是 ________________。
②空气中钼酸盐对碳钢的缓蚀原理是在钢铁表面形成FeMoO4—Fe2O3保护膜。
密闭式循环冷却水系统中的碳钢管道缓蚀,除需加入钼酸盐外还需加入NaNO2。则NaNO2的作用是 _________________________________________。
③若缓释剂钼酸钠—月桂酸肌氨酸总浓度为300mg·L-1,则缓蚀效果最好时钼酸钠的物质的量浓度为
(6)锂和二硫化钼形成的二次电池的总反应为:xLi + nMoS2
 Lix(MoS2)n。则电池放电时的正极反应式是:___________________________________。
Lix(MoS2)n。则电池放电时的正极反应式是:___________________________________。推荐回答
试题答案:(1)①增长钼精矿与空气接触的时间,使其充分反应,提高原料的利用率 (1分) ②实现热量交换,节约能源 (1分)(2)2MoS2 + 7O2 = 2MoO3 +4 SO2(高温)(2分)(3)MoO3+CO32-= MoO42-+CO2↑ (2分)(4)多次使用后母液中杂质的浓度增大,再次重结晶时会析出杂质影响产品纯度(2分)(5)①Cl-有利于碳钢的腐蚀,SO42-不利于碳钢的腐蚀,使得钢铁在盐酸中的腐蚀速率明显快于硫酸;(1分) 硫酸溶液随着浓度的增大,氧比性增强,会使钢铁钝化,腐蚀速率减慢 (1分)②替代空气中氧气起氧化剂作用 (2分) ③7.28×l0-4mol·L-1(2分)(6)nMoS2 + xLi+ + xe- = Lix(MoS2)n (2分)以上问题属网友观点,不代表本站立场,仅供参考!
- 上一条:为了研究外界条件对H2O2分解反
- 下一条:2SO2+O2⇌2SO3是工业上制造硫