已知可逆反应:N2(g)+3H2(g) 2NH3(g)△H=-92kJ•mol-1下列关于此反应的说法中错误的是()A.加压可使该反应的反应速率变大B.升高温度,该反应的正、逆反应速率均变大C.将1
发布时间:2019-08-07 04:40:46
试题难度:难度:中档 试题类型:单选题 试题内容:已知可逆反应:N2(g)+3H2(g)
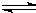
2NH3(g)△H=-92kJ•mol-1下列关于此反应的说法中错误的是( )A.加压可使该反应的反应速率变大B.升高温度,该反应的正、逆反应速率均变大C.将1molN2和3molH2混合进行反应,反应完成时放出的热量为92kJD.单位时间内生成1molN2,同时消耗3molH2说明该反应达到平衡状态
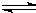
2NH3(g)△H=-92kJ•mol-1下列关于此反应的说法中错误的是( )A.加压可使该反应的反应速率变大B.升高温度,该反应的正、逆反应速率均变大C.将1molN2和3molH2混合进行反应,反应完成时放出的热量为92kJD.单位时间内生成1molN2,同时消耗3molH2说明该反应达到平衡状态
推荐回答
还没有选出推荐答案,请稍候访问或查看其他回答!以上问题属网友观点,不代表本站立场,仅供参考!