【题文】(14分)目前机动车使用的电池品种不少,其中铅蓄电池的使用量最大。I.铅蓄电池的电极材料分别是Pb和PbO2,电解质溶液为稀硫酸。铅蓄电池充放电的总反应方程式为:PbO2+Pb+2H2SO42
发布时间:2019-08-07 04:12:11
试题难度:困难 试题类型:填空题 试题内容:【题文】(14分)目前机动车使用的电池品种不少,其中铅蓄电池的使用量最大。
I.铅蓄电池的电极材料分别是Pb和PbO2,电解质溶液为稀硫酸。铅蓄电池充放电的总反应方程式为:
PbO2+Pb+2H2SO4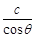 2PbSO4+2H2O,
2PbSO4+2H2O,
请根据上述情况判断:
(1)电池的负极材料是 。
(2)充电时,铅蓄电池阳极的电极反应式为 。
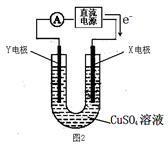
Ⅱ.铅蓄电池使用量的急速增加引起铅污染日益严重,工业上从废铅蓄电池的铅膏回收铅的一种工艺流程如下:

请回答下列问题:
(3)为提高步骤①的化学反应速率,你认为可采取的措施是 (写一条即可)。
(4)写出步骤①中PbSO4转化为PbCO3反应的平衡常数表达式:K = 。
(5)步骤①中发生氧化还原反应的化学方程式为 。
(6)步骤③从母液可获得的副产品为 (写化学式)。
(7)已知:PbCO3在一定条件下可制得PbO,PbO通过进一步反应可制得Pb,写出一个由PbO生成Pb的化学方程式: 。

I.铅蓄电池的电极材料分别是Pb和PbO2,电解质溶液为稀硫酸。铅蓄电池充放电的总反应方程式为:
PbO2+Pb+2H2SO4
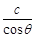 2PbSO4+2H2O,
2PbSO4+2H2O,请根据上述情况判断:
(1)电池的负极材料是 。
(2)充电时,铅蓄电池阳极的电极反应式为 。
Ⅱ.铅蓄电池使用量的急速增加引起铅污染日益严重,工业上从废铅蓄电池的铅膏回收铅的一种工艺流程如下:

请回答下列问题:
(3)为提高步骤①的化学反应速率,你认为可采取的措施是 (写一条即可)。
(4)写出步骤①中PbSO4转化为PbCO3反应的平衡常数表达式:K = 。
(5)步骤①中发生氧化还原反应的化学方程式为 。
(6)步骤③从母液可获得的副产品为 (写化学式)。
(7)已知:PbCO3在一定条件下可制得PbO,PbO通过进一步反应可制得Pb,写出一个由PbO生成Pb的化学方程式: 。
推荐回答
试题答案:【答案】(14分)(1)Pb (2分)(2)PbSO4+2H2O—2e = PbO2+4H++SO42 (2分)(3)充分搅拌;适当升高温度;增大碳酸钠和亚硫酸钠的浓度(合理答案均给分,2分)(4)(2分)(5)PbO2+Na2SO3 +H2O = PbSO4+2NaOH或PbO2 + Na2SO3 + Na2CO3 + H2O = PbCO3 + Na2SO4 + 2NaOH (2分)(6)NaOH、Na2SO4(2分)(7)PbO + CO Pb + CO2(2分,还原剂应C、H2、Al等合理答案均可) 试题解析:【解析】试题分析:(1)根据铅蓄电池充放电的总反应方程式,放电时Pb失去电子,所以负极的负极材料是Pb。(2)充电时,铅蓄电池阳极上PbSO4失去电子,配平可得电极方程式:PbSO4+2H2O—2e = PbO2+4H++SO42 (3)充分搅拌可使反应物充分混合,升高温度、增大反应物的浓度都可以提高化学反应速率。(4)写出步骤①中PbSO4转化为PbCO3反应的离子方程式为:PbSO4(s) + CO32 (aq) = PbCO3(s) +SO42 (aq),所以平衡常数表达式:K =(5)根据化学流程中的信息,步骤①中发生氧化还原反应的氧化剂为PbO2,还原剂为Na2SO3,所以化学方程式为:PbO2+Na2SO3 +H2O = PbSO4+2NaOH或PbO2 + Na2SO3 + Na2CO3 + H2O = PbCO3 + Na2SO4 + 2NaOH(6)根据(5)的分析,经过氧化还原反应生成副产品Na2SO4和NaOH,所以步骤③从母液可获得的副产品为:NaOH、Na2SO4(7)PbO生成Pb,需要加入还原剂,如CO、H2、C、Al等,所以化学方程式为:PbO + CO Pb + CO2等。考点:本题考查原电池与电解池原理、化学流程的分析、化学反应速率的影响因素、氧化还原反应原理。以上问题属网友观点,不代表本站立场,仅供参考!
- 上一条:【题文】(8分)下图是探究不同条
- 下一条:【题文】电解饱和食盐水的装置